糖尿病網膜症 |
糖尿病 diabetes mellitus:

糖尿病 DM は,インスリン作用の不足による慢性高血糖を主徴とし,種々の特徴的な代謝異常を伴う症候群である.その発症には遺伝因子と環境因子がともに関与する.代謝異常の長期間にわたる持続は動脈硬化症を促進させ,特有の合併症をきたし易くなる.
合併症は糖尿病神経障害・糖尿病網膜症・糖尿病関連腎臓病(糖尿病性腎症)で,細(小)血管障害 microangiopathy(三大合併症.頻度順)という.DMが危険因子となり罹患率が高まるとされる疾患には脳血管障害・虚血性心疾患・閉塞性動脈硬化症があり,大血管障害 macroangiopathy という.臨床研究では,有網膜症あるいは細小血管障害の発症・進行・重症度が,大血管障害の発症ハザード比を高めるリスクファクターであることが示されている.
「糖尿病性網膜症」とは合併症というより血管変化は糖尿病病変そのもの,との考え方による.網膜症は罹病期間に比例して発症し,糖尿病患者の3人に1人は有網膜症と推計される.また視力障害は緑内障,加齢黄斑変性とともに,成人における中途失明原因(視覚障害認定交付)の上位三疾患の一つである.
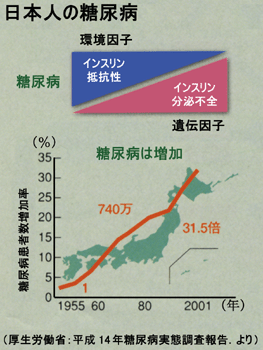
| ✓☞ | 推計糖尿病患者数:950万人(2012年),1000万人(2016年).厚生労働省 |
| ✓☞ | 網膜症と他の合併症との関連: |
糖尿病網膜症 diabetic retinopathy は高血糖 hyperglycemia による眼底の微小循環障害,すなわち
高血糖下では酸化ストレス亢進に伴い,
蛋白糖化最終産物 advanced glycation end products
| ✓☞ |
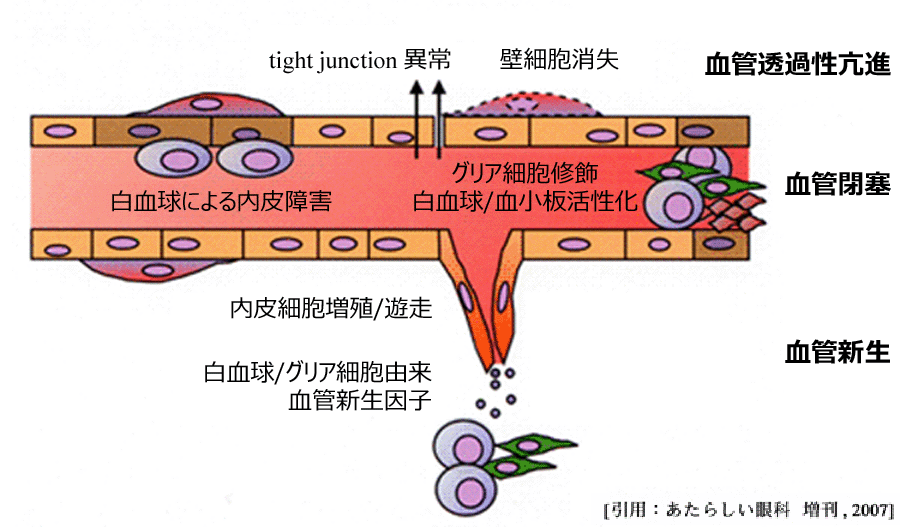
血管内皮細胞の分裂・増殖+血管透過性亢進+白血球の変形能の低下・粘着能の亢進・血管壁への付着+各種生理活性物質 =
炎症反応 |
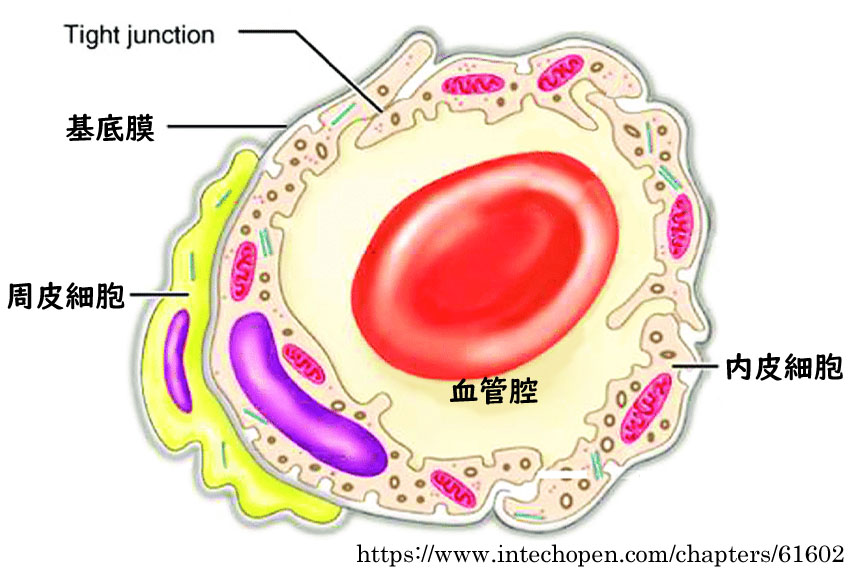
| ✓☞ | 周皮細胞の消失:周皮細胞は内皮細胞を制御している.AGEによる周皮細胞の脱落は細胞種間相互作用を破綻させ,血管新生や血栓傾向を招くと推定される.
【 |
| ✓☞ | 基底膜の肥厚:細胞外マトリクスの蓄積,血漿成分の蓄積,など. |
| ✓☞ | 血栓:内皮細胞の損傷,血小板凝集能の亢進,白血球粘着能の亢進,血液凝固の亢進,線溶能の低下,など. |
| ✓☞ | 高血糖下の白血球は:変形能が低下し内皮へ接着しやすくなっている.毛細血管での血流障害の原因として,内皮細胞傷害の第一段階・最初期変化,とのことである.動物実験では,網膜深層での傷害が最も著しかったとされる. |
| ✓☞ | 硝子体中では:炭酸脱水酵素が増加.pHの上昇から血管透過性亢進を起こすとのこと.一方で,血管内皮増殖抑制作用や遊走抑制作用が低下する. |
| ✓☞ | 抗II型コラーゲン抗体:糖尿病において血清中自己抗体価の上昇がみられるとのこと.増悪因子としての自己免疫が注目されている. |
眼底の代謝環境が悪化すると,網膜浮腫・毛細血管瘤形成・毛細血管閉塞が進行し,
サイトカインにより血管内皮細胞・線維芽細胞の増殖がさらに促される.
周皮細胞が変性・消失した血管壁異常部分では血管の変形が進行し,高率に毛細血管瘤が形成される,と考えられている.
毛細血管瘤は,小動脈から毛細血管に移行する部位で,かつ内顆粒層に多発する.これらは灌流圧調整の負荷が大きい部分であるとか,エネルギー代謝が活発な部分であるため,血管瘤形成 → 陳旧化が網膜内循環障害を加速させる,と解釈されている.
| ✓☞ | 毛細血管瘤:周皮細胞は血管新生を抑制している.病理組織的にみれば,毛細血管瘤形成には内皮増殖が関連し新生血管の一環となっている.既に増殖プロセスが動いている中での臨床像解釈との乖離は承知の上となる. |
| ✓☞ | 無潅流領域:毛細血管形態の変化や閉塞の部位には特徴がある.中間周辺部がキモである. |
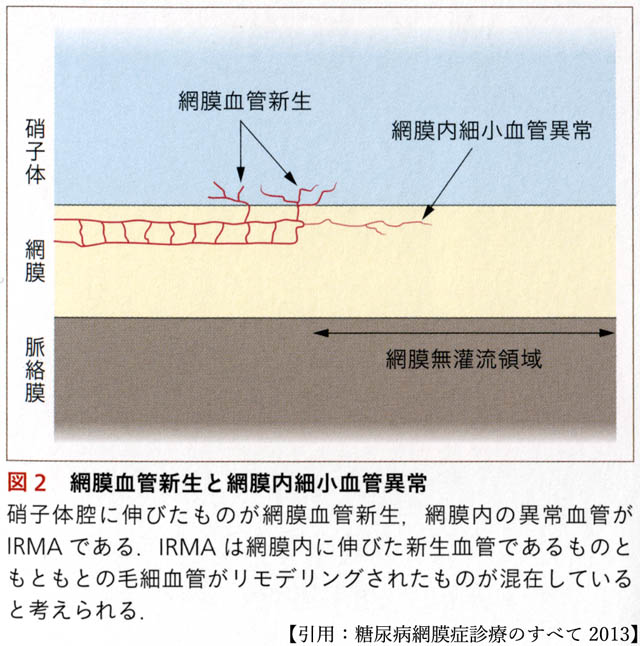
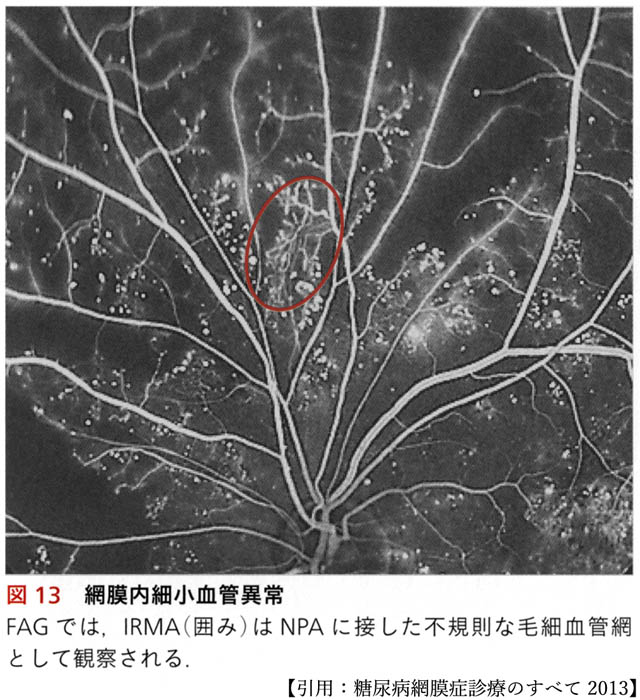
網膜症の本質は,無潅流領域 non-perfusion area (NPA) の拡大,つまり虚血である.虚血環境で増殖した内皮細胞は,管腔をつくり新生血管となる.新生血管は無血管領域の境界や血管構築形態が変化する領域,あるいは異なる血液循環系の接点で発生・成長する.
眼底網膜の血管構築は後極部から中間周辺部にかけて最表層(神経線維層レベル)の毛細血管網構造が段階的に疎になる.これより周辺部で緩徐な血管閉塞が進行する.眼内の循環系とは網膜循環と脈絡膜循環であり,それらの接点は虹彩・毛様体部と視神経乳頭部である.すなわち新生血管の„好発部位“とは,血管床閉塞に沿った領域と視神経乳頭部,及び虹彩・毛様体部である.
眼底では,網膜内細小血管異常 intraretinal microvascular abnormalities
虹彩面・隅角線維柱帯は血管内皮と親和性が高く,増殖した内皮細胞が隅角に張り付くと房水流出の抵抗のため眼圧のコントロールが出来なくなる.この病態が続発緑内障(血管新生緑内障)である.なお,透過性亢進による房水変化でも流出抵抗増大をきたし得る. 【 血管新生 】 【 続発緑内障 】
| ✓☞ | 新生血管: |
新生血管は硝子体腔に向かうことから,„虚血状態を改善するため“ ・・・ のような説明は意味をなさない.しかし,
網膜内に増殖血管を誘導できれば,虚血状態の改善につながるとの観点での治療法が期待されている.
| ✓☞ | 虹彩ルベオーシス: 眼内虚血病変や慢性炎症などによる新生血管のパターンの一つとして説明される.ただし糖尿病に於ては,小虹彩輪部に好発し,やがて虹彩全面に増殖膜をきたしぶどう膜外反を生ずるに至る,という経過が注目され,rubeosis iridis diabetica (1928) として特殊な血管新生とされてきた歴史がある. |
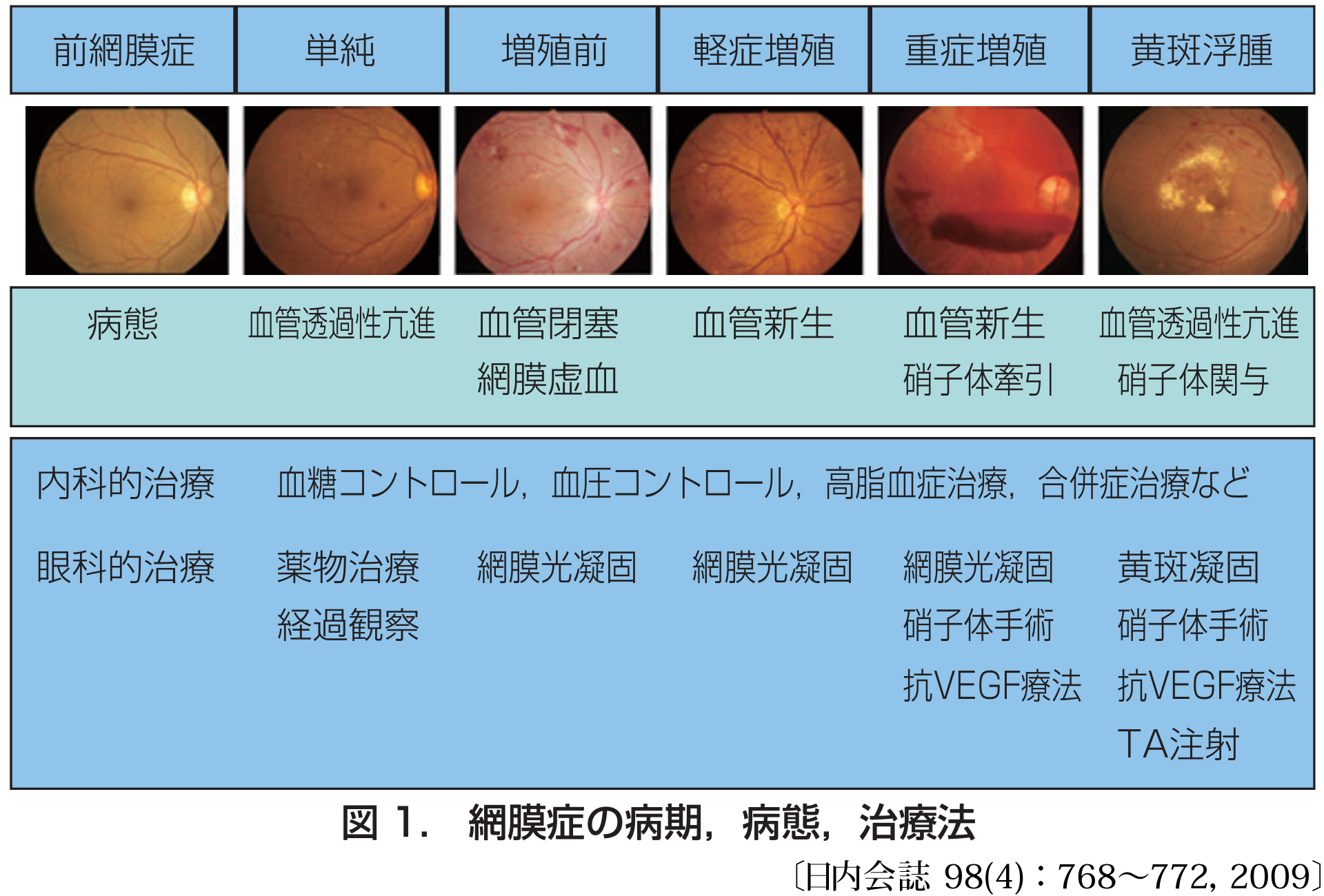
視機能喪失をきたす病態 visionⲻthreatening diabetic retinopathy;VTDR は,黄斑症と増殖網膜症である.視力は黄斑部の状態に依存することで,しばしば網膜症の程度(重症度)とは一致しない.
黄斑症 maculopathy とは,(囊胞様)黄斑浮腫,虚血変化,それらに続発する網膜色素上皮障害である.黄斑浮腫(DME)は網膜症全体の
1∕4
ほどに合併する.網膜症自体の進行程度にかかわらずどの時期でも発症しうるもので,亢進した血管透過性により内顆粒層や外網状層に生じ,黄斑機能が損なわれる.
【 ☞ 糖尿病黄斑症 】
増殖 proliferation とは,ひとつは牽引性網膜剝離の発症を意味し網膜全体の機能が損なわれる.もうひとつは血管新生緑内障の発症を意味し視神経機能が損なわれる.多くが最終的な病態である.
【 ☞ 牽引剝離のイメージ図 】
網膜症の発症は,糖尿病診断後平均8年とされる.初診時点で
HbA1C値8.5%以上(JDS値)で網膜症発症のリスクが上昇する.新たな発症は年に3.3%ほどと考えられている.悪化率は1%ほどである.
別のデータでは,罹病5年で10%,罹病10年で30~50%,20年では70~80%で何らかの所見が認められる.
一般に合併症は,神経障害>網膜症>腎障害の順で発症する.また,動脈硬化で代表される加齢変化が加速する.動脈硬化年齢は実年齢の120%歳といわれる.これにより非糖尿病と比べ,循環障害(脳梗塞・心筋梗塞)の発症は糖尿病予備群で2倍,糖尿病群で3倍とのことである.また有網膜症では4人に1人の割合で冠動脈疾患が見つかっている,とのことである.網膜症が進行すると非増殖網膜症で1.3倍,増殖網膜症で2倍の心筋梗塞・死亡数となるそうである.
眼底所見はまず出血の形や分布をチェックする.出血点と区別がつきにくいのが毛細血管瘤であるが,小さい赤点
(ETDRSでは径125㎛以下)
の散在は毛細血管瘤としてよい.浮腫の存在を確認することは相当に難しいので白斑を頼りにする.硬性白斑は浮腫の存在を,軟性白斑は虚血の存在を示しているからである.
蛍光眼底造影写真❰☞ 画像 例❱ではまず点々と毛細血管瘤が目に留まる.過蛍光(漏出)をマークすれば血管瘤の周囲と共に,低蛍光野の周囲にも過蛍光を生じている.
さらに血管特に静脈の変形は前増殖期の所見として隣接する領域の虚血変化を示唆し,部分的な過蛍光は増殖変化への移行を強く疑う.低蛍光野の中の目が粗くやや拡張した毛細血管は,
網膜内細小血管異常 intraretinal microvascular abnormalities
なお, 糖尿病黄斑症 は,ステージ分類とは別に扱う.
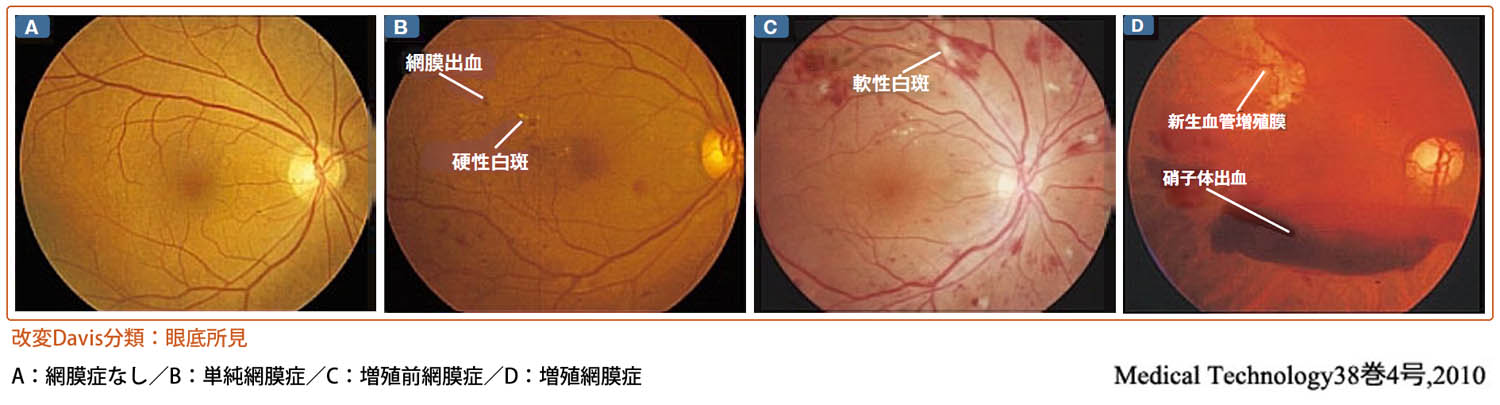
●Davis分類
臨床的に運命を決めるのは新生血管(増殖変化)の有無であり,基本病態と対応できるので明快である.すなわち,透過性亢進 ➡ 単純網膜症,虚血変化 ➡ 増殖前網膜症,血管新生 ➡ 増殖網膜症,である.これにより三段階に分ける.
元は末期・鎮静状態として退行期網膜症の記述があったがこれを止め,蛍光眼底造影所見を導入して„改変“となった.„網膜症なし“を加え4期とすることもある.
▩☞ 増殖網膜症へ進行する前段階に注目した分類として評価されている.ただし,治療後の変化は考慮されていない.
▩☞ ついでに『前』であるが,日本語では一般に後ろに付ける筈である.夜明け前とか就寝前・・・.そうすると前増殖網膜症というのは少々具合が悪い.また,前増殖期なり前増殖型では違和感はない(逆に『前』を後ろに持ってくると落ち着かない).
●Scott分類
古典的であるが教科書的に重要である.おおよそ以下のようなものである.
| Scott | 所 見 | 病 態 | 進展様式 |
|---|---|---|---|
| 第 0 期 | 病的所見を認めず | 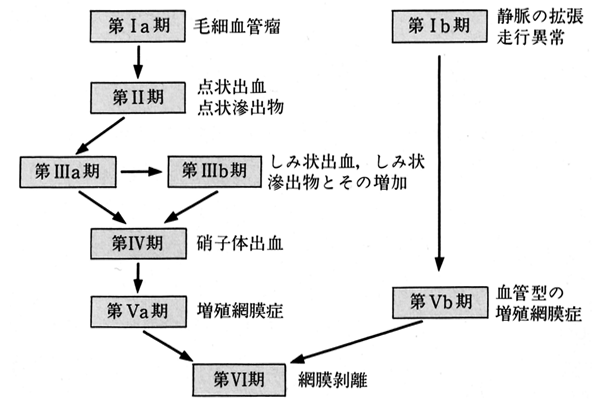 | |
| Ⅰa | 毛細血管瘤 | 単純網膜症 | |
| Ⅰb | 静脈の変形・軟性白斑・高度の浮腫 | 増殖前網膜症 | |
| Ⅱ | 出血・硬性白斑 | 単純網膜症 | |
| Ⅲa~b | 出血・白斑の増加 | 単純網膜症 | |
| Ⅳ | 硝子体出血 | 増殖網膜症 | |
| Ⅴa | 線維血管膜 | 〃 | |
| Ⅴb | 線維血管膜(強い静脈変化 | 〃 | |
| Ⅵ | 網膜剝離 | 〃 |
注:Scott分類では,Ⅳ.硝子体出血 → Ⅴ.増殖網膜症 と進行するような病期分類であるが,実際は増殖つまり血管新生が先にあって硝子体出血をきたすものである.Scottのオリジナル(1951,53,57)では蛍光眼底造影検査法はこの世に存在していなかった.新生血管発生の病態が確認されたのはその後のことであるので止むを得ない.
Ⅰ(b) → Ⅴ(b)が重症・活動性の増殖過程(いわゆるB群),Ⅴ(a)は軽症の新生血管』という認識となる.51~57年版でⅡ(a)(b)(c)などとあるにはあるが,煩雑だろう.そうすると,新生血管の発生タイミングは ・・・ 強いて言えば Ⅲ(c) となるか ?
ちなみに,Scott分類は生きた化石である(大事にしよう).
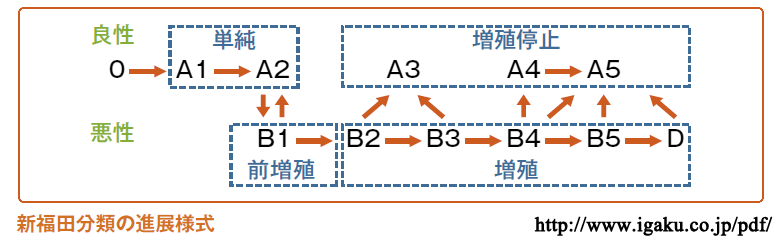
●福田分類
Scott分類を発展させて考案された(1979,91).
| 良性網膜症(A群) | 所 見 | ||
|---|---|---|---|
| 単純網膜症 | A1:軽症単純網膜症 | 毛細血管瘤・点状出血(わずかな硬性白斑があってよい | |
| A2:重症単純網膜症 | しみ状出血・硬性白斑(わずかな軟性白斑があってよい | ||
| 増殖停止網膜症 | A3:軽症増殖停止網膜症 | 軽症・陳旧性新生血管 | |
| A4:重症増殖停止網膜症 | 陳旧性硝子体出血(半年以上進行なし | ||
| A5:重症増殖停止網膜症 | 陳旧性増殖組織(半年以上進行なし | ||
| 悪性網膜症(B群) | |||
| 軽症悪性網膜症 | B1:増殖前網膜症 | 明らかな活動性病変 ( 網膜内細小血管異常・軟性白斑・火炎状出血・網膜浮腫・静脈拡張・蛍光眼底造影での無血管領域 など | |
| B2:早期増殖網膜症 | 乳頭部以外の新生血管( 検眼鏡的に増殖組織なし) | ||
| 重症悪性網膜症 | B3:中期増殖網膜症 | 乳頭部の新生血管( 検眼鏡的に増殖組織なし) または 後極部のびまん性浮腫 | |
| B4:末期増殖網膜症 | 新鮮な網膜出血,硝子体出血 | ||
| B5:末期増殖網膜症 | 進行性の(硝子体中の線維血管性)増殖組織,出血 | ||
| 合併症(治療歴 | |||
| (M):黄斑病変 | (N):虚血性視神経症 | ||
| (G):血管新生緑内障 | (D):(牽引性)網膜剝離 | ||
| (P):光凝固後 | (V):硝子体手術後 | ||
●国際重症度分類
(International Clinical Diabetic Retinopathy Disease Severity Scale.AAO,2002)
網膜症と黄斑症を重症度分類とした.臨床に即しETDRS分類を簡潔にした.
| 網膜症重症度レベル | 所 見 |
|---|---|
| 網膜症なし | 異常所見なし |
| 軽症非増殖網膜症 | 毛細血管瘤のみ |
| 中等症非増殖網膜症 | 毛細血管瘤以上の所見がみられるが,次の所見よりも軽症1) |
| 重症非増殖網膜症 | 以下の所見のどれかを認め,かつ増殖所見のないもの2) 1.20個以上の網膜内出血を眼底四象限で認める 2.はっきりとした数珠状静脈を眼底二象限で認める 3.明確な網膜内細小血管異常(IRMA)を認める |
| 増殖網膜症 | 以下の所見のいずれかを認めるもの 1.新生血管 2.硝子体/網膜前出血 |
リスク
1) 1 年後の早期増殖網膜症への進展:5.4⁓26%
1 年後のハイリスク増殖網膜症への進展:1.2⁓8.1%
2) 1 年後の早期増殖網膜症への進展:50.2%
1 年後のハイリスク増殖網膜症への進展:14.6⁓45.01%
問題点
進行予測に有意に関連する所見として,出血・IRMAを含む静脈異常・新生血管に絞っている.
一方で,軟性白斑≒虚血,という点を無視している.蛍光眼底造影所見に頼らないことで,虚血変化の概念をカットしたのか ? 数珠状静脈を見つければ虚血アリ,と見做すのか ? 単純化しようとしたのか ?
| 黄斑症重症度レベル | 所 見 |
|---|---|
| 糖尿病黄斑浮腫なし | 後極部に網膜浮腫による肥厚,硬性白斑がない |
| 糖尿病黄斑浮腫あり | |
| 軽症黄斑浮腫 | 中心窩から離れている |
| 中等症黄斑浮腫 | 中心窩に近いが中心窩を含んでいない |
| 重症黄斑浮腫 | 中心窩を含んでいる |
問題点
詳細は略すが,光凝固治療の基準にしては中心窩からの距離が示されていないという指摘がある.もっと現実には,黄斑浮腫は極めて厄介な病態で,最近では光凝固だけでなくいくつかの手段を組み合わせる治療を検討する.
およそEBMとかエビデンスなるものは治療の拠りどころ(レシピ)ではあり,全国的あるいは世界的な医療水準の維持に貢献しているに違いない.研究の立場ではデータの比較に共通の条件は不可欠である.他方ではEBMに従わないと訴訟時に不利だったりする.
が,ひとりひとりの病態の個性には対応し切れない.この 「さじ加減」というのはどの分野にも当てはまるようである.
●ETDRS分類
(Early Treatment Diabetic Retinopathy Study.1985,91)
ほとんど研究用
| Davis分類 | 新福田分類 | 国際重症度分類 |
| 網膜症なし 異常所見なし | ||
| 単純網膜症 毛細血管瘤 網膜点状・斑状・線状出血・硬性白斑・網膜浮腫 (少数の軟性白斑) | A1:軽症単純網膜症 毛細血管瘤・点状出血(わずかな硬性白斑があってよい | 軽症非増殖網膜症(mild) 毛細血管瘤のみ |
| A2:重症単純網膜症 しみ状出血・硬性白斑(わずかな軟性白斑があってよい | 中等症非増殖網膜症(moderate) 毛細血管瘤以上の所見がみられるが,次の所見よりも軽症 | |
| 増殖前網膜症 軟性白斑(綿花様白斑)・静脈異常・網膜内細小血管異常 (網膜無灌流領域:蛍光眼底造影) | B1:増殖前網膜症 明らかな活動性病変(網膜内細小血管異常・軟性白斑・火炎状出血・網膜浮腫・静脈拡張・蛍光眼底造影での無血管領域 など | 重症非増殖網膜症(severe) 以下の所見のどれかを認め,かつ増殖所見のないもの 1.20個以上の網膜内出血を眼底4象限で認める 2.はっきりとした数珠状静脈を眼底2象限で認める 3.明確な網膜内細小血管異常(IRMA)を認める |
| 増殖網膜症 新生血管(網膜・乳頭上) 網膜前出血,硝子体出血 線維血管膜 牽引性網膜剝離 | A3:軽症増殖停止網膜症 軽症・陳旧性新生血管 A4:重症増殖停止網膜症 陳旧性硝子体出血(半年以上進行なし A5:重症増殖停止網膜症 陳旧性増殖組織(半年以上進行なし B2:早期増殖網膜症 乳頭部以外の新生血管(検眼鏡的に増殖組織なし) B3:中期増殖網膜症 乳頭部の新生血管(検眼鏡的に増殖組織なし)または 後極部のびまん性浮腫 B4:末期増殖網膜症 新鮮な網膜出血,硝子体出血 B5:末期増殖網膜症 進行性の(硝子体中の線維血管性)増殖組織,出血 |
増殖網膜症 以下の所見のいずれかを認めるもの 1.新生血管 2.硝子体出血/網膜前出血 |

蛍光眼底造影(FA)では,血管病変すなわち毛細血管瘤・毛細血管閉塞・網膜内細小血管異常・新生血管の確認,透過性亢進・囊胞形成の確認ができる.
網膜電図(ERG)では,律動様小波(内顆粒層,特にamacrine細胞起源)が減弱・消失する.虚血が強くなると,b波(Müller細胞・双極細胞起源)の振幅が小さくなる(negative-b).これらは網膜内層の障害を示している.さらにS錐体ERGの研究では,感度低下は病早期から起こり,網膜外層に於ても異常が生じている,とのことである.
眼球電図(EOG)では,高浸透圧応答が減弱する.網膜色素上皮ないし脈絡膜の障害を反映することで,ERGa波およびb波の減弱に関連する,と説明される.
▩☞ 網膜内細小血管異常(あるいは網膜内微小血管異常;IRMA)は,主に蛍光造影所見を基とする.網膜毛細血管網の形に似たものと異常な走行を示す毛細血管がみられ,新生血管のカテゴリーと見做す.ただし,透過性亢進はあまり強くはない.
▩☞ OCT/OCT-A によると,網膜神経の代謝環境がいかに良くないか,瞭然
▩☞ S錐体は,虚血環境に脆弱らしい.
▩☞ 律動様小波の消失は,レーザー治療の必要性を示している.陰性ⲻbでは増殖変化へのハイリスクを示している. ☞ 電気生理
★網膜症の自然経過例
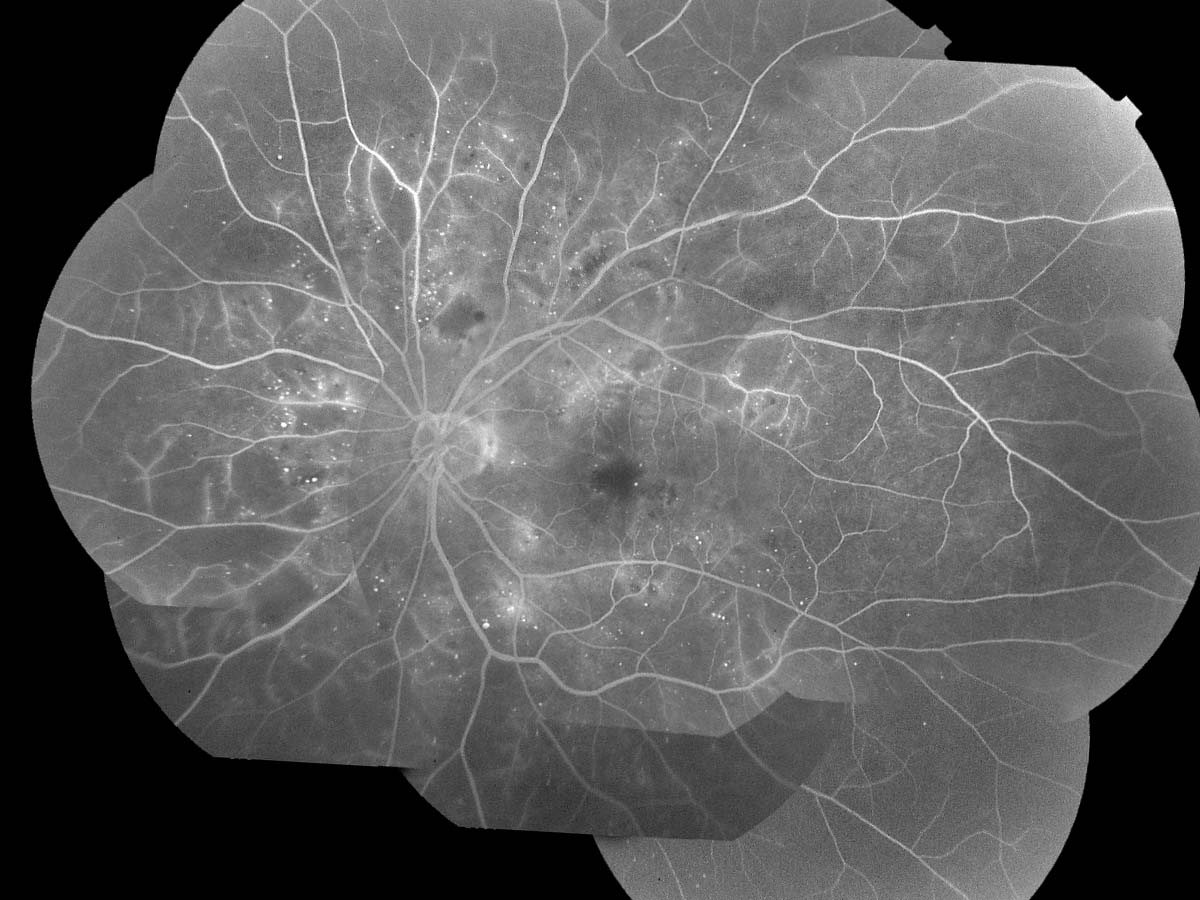 |
→→ ca. 10y |
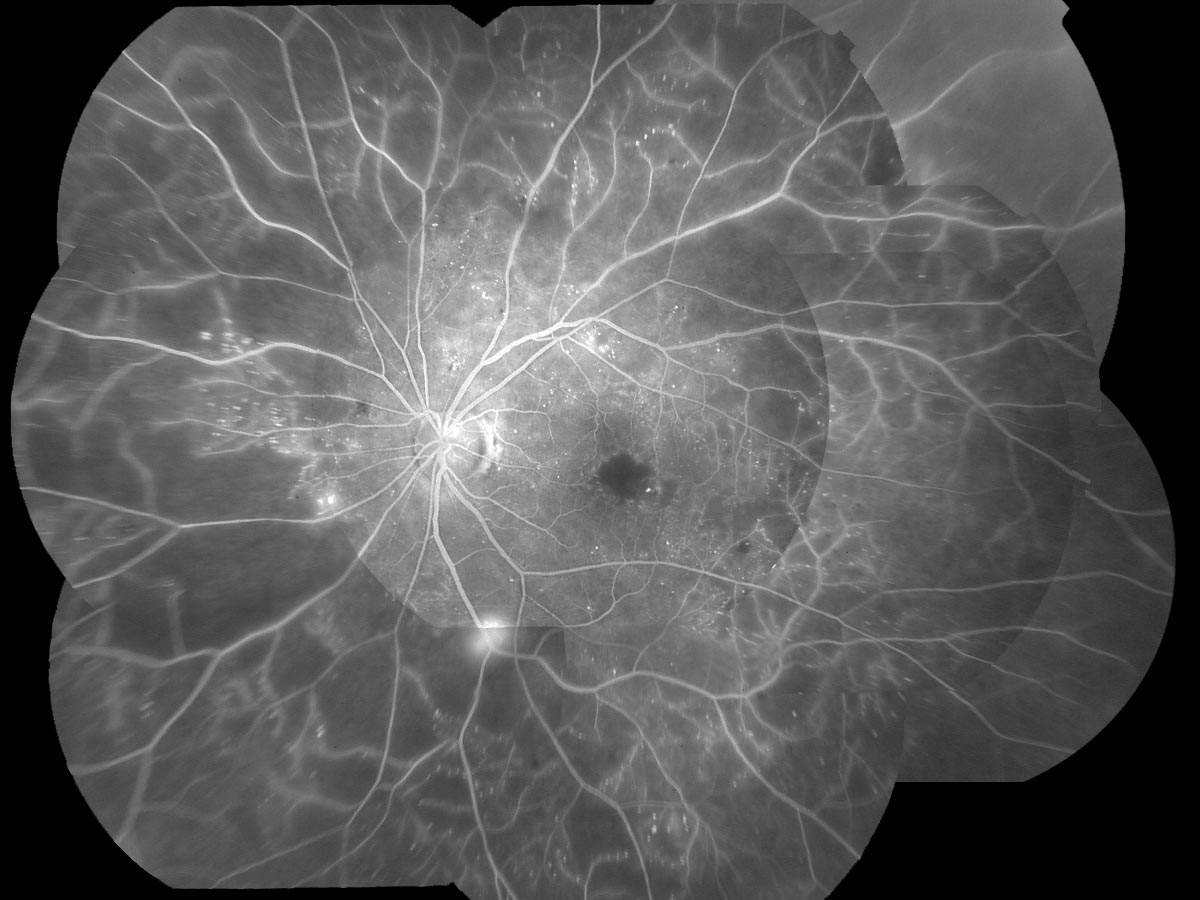 |
長期高血糖では,網膜症を発症する以前より網膜毛細血管の血流が減少しており,内顆粒層および内網状層の菲薄化や中層・深層の網膜内毛細血管の異常が報告されている.
これらは糖尿病状態の初期変化として,Müller細胞障害 ⁄ amacrine細胞障害 ⇆ 毛細血管障害 が起きていることを示している.
血管透過性亢進の存在や律動様小波(oscillatory potentials:OP)の早期障害と関連する.
低酸素応答と共に高血糖下の Müller細胞はVEGFを産生し,網膜毛細血管の透過性を亢進させる(tight junctionの構成蛋白質をリン酸化し,バリア機能を低下させる).
Müller細胞の機能障害により神経栄養因子の産生が低下し, amacrine細胞の活性が低下する.グルタミン酸濃度が増加し,グルタミン酸興奮性毒性は神経細胞の不可逆的損傷をきたす.
酸化ストレスによりグリア細胞は多くの炎症因子を分泌し,網膜を長期に炎症状態にする.網膜神経保護因子の不均衡は網膜内の環境安定を破壊し,神経細胞の変性・アポトーシスを引き起こし,早期の微小血管病変を誘導する.
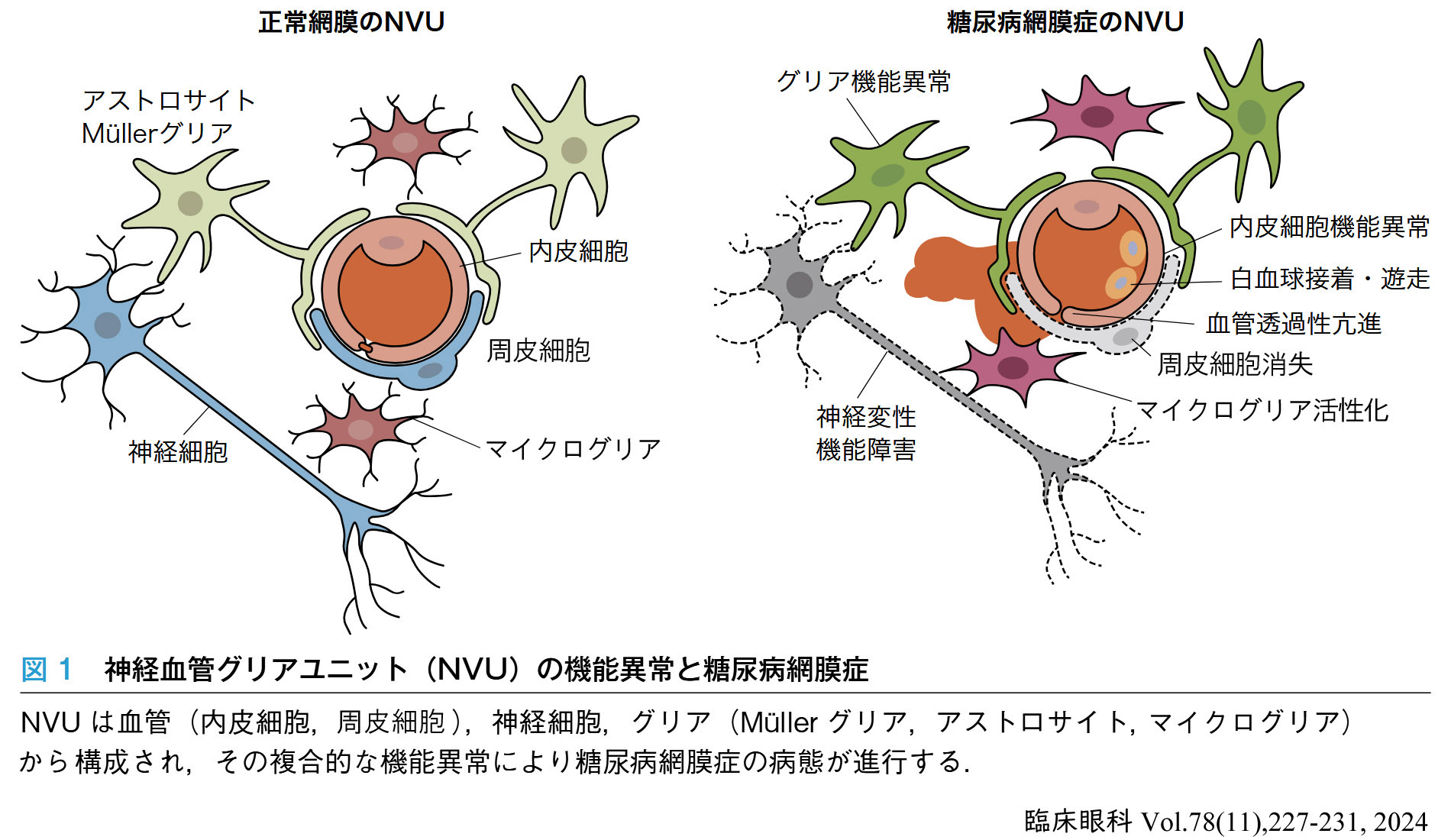
微小血管異常とニューロン変性とは相互に影響し,最終的に網膜神経血管ユニット破壊の悪循環に至り,不可逆的網膜症を引き起こす.
| ✓☞ | 増殖因子: 低酸素状態下で過剰に発現するサイトカイン.グリア細胞のほか,amacrineを含むニューロン,血管内皮細胞や周皮細胞など,ほとんどが血管内皮増殖因子 VEGF を産生する.マクロファージの関与もある.VEGFは血管新生・透過性亢進に関与する,最も重要な役割を担うサイトカインの一つ. |
| ✓☞ | 低酸素応答: 神経血管ユニット(neurovascular unit;NVU)は,低酸素誘導因子の機能を介し低酸素センサとして働く. |
| ✓☞ | 網膜神経保護因子: |
視力(自覚症)は網膜症の程度・進行(重篤度)とは,しばしば一致しない.視力を左右するのは,たいてい黄斑障害の程度と透光体の混濁ということになる.黄斑障害といえば主原因は浮腫あるいは牽引剥離であり,透光体混濁は硝子体出血あるいは白内障といったところである.
本症は悲惨な予後がはっきりしている.増殖網膜症が単純網膜症になる(戻る)ことは,あり得ない.これにより治療のスタンスは視機能の保存という事になる(主な責任部位が透光体である場合は例外的に視力の回復が期待できる).
治療は内科的な血糖コントロールが第一.
網膜症のリスクが著明に増加するのは,‘HbA1C 6.5%以上(JDS値)’,‘空腹時血糖値 140mg/dℓ 以上’,‘75g経口糖負荷試験で 2時間値 230~240mg/dℓ 以上’である.網膜症悪化を抑制する血糖コントロール閾値は,‘HbA1C 6.5%以下(JDS値)’,‘空腹時血糖 110mg/dℓ 以下’,‘食後2時間血糖180mg/dℓ 以下’である.
現在,網膜症の程度と統計学的に相関する全身状態は「HbA1C」である.初診時HbA1C 8.5%以上(JDS値)は,網膜症発症の危険因子である.HbA1C 7%前後(JDS値)でコントロールされた場合の網膜症発症リスクは,9%のコントロールで3年以上経過した時の1∕4である.同様に網膜症進展リスクは1∕2である.HbA1C値を 1 ポイント低下させることで,網膜症の発症・進展を21%抑制できる.10%低下させると25%抑制できる.
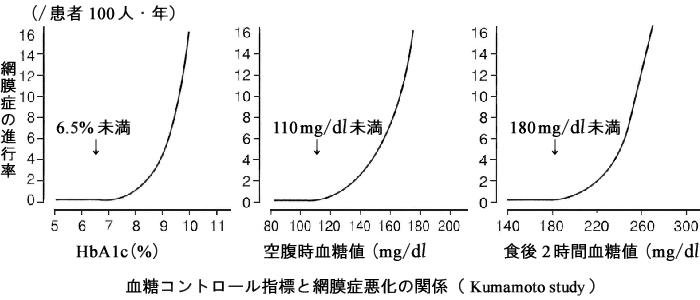
HbA1C 6.5%未満(JDS値)であれば一部の可逆性変化も含め網膜症の発症・進展は有意に押さえられる,ということから,
高血圧(収縮期圧10mmHg の低下で網膜症悪化リスクが13%減少),高脂血症(特にLDLコレステロール対策.高HDLコレステロール値が進行抑制に関係するという),喫煙,肥満に対する管理などを要する.
一方,血糖コントロールの際に急激に(6か月でHbA1C値 3%以上)下降させると網膜症の進行が認められる.特に未治療例では内科治療を始めたとたんに網膜症が悪化・視力が低下するといったことが少なくない(治療後網膜症).罹病期間10年以上,当初のHbA1C 9%以上(JDS値),血管透過性亢進の強い網膜症(福田 AⅡ・bⅠ)を有する場合にリスクが高い.この初期悪化(early worsening)は開始6から12か月で顕著であることがわかっている.よってコントロール当初の血糖下降速度が極めて重要である.
重症低血糖についても網膜症発症・進行のほか生命予後の悪化につながる,と指摘されている.
糖尿病合併妊娠では網膜症が急激に悪化する.網膜光凝固治療が間に合わなかったりする.
●HbA1c / 糖化ヘモグロビン:血糖マーカーとして過去2か月前後の平均的な血糖の状態を反映する.半面,血糖値の変動の大きい症例では血糖状態の実態から乖離する.基準値は網膜症・腎症・末梢神経障害といった糖尿病の細小血管合併症を基に検討された.
なお,
以上の数値は2012年以前の記述がそのままである(JDS値).その後検査法の変更のため基準値が変わっている.これについては読み替えの注意が必要である.
【 ☞ 基準値の読み替えについて は 】
レーザー光凝固は,照射部の網膜・脈絡膜を瘢痕・萎縮させることで,栄養・酸素要求量が制限され増殖因子の放出抑制をはかる.すなわち相対的に代謝環境を是正することで,正常部(特に黄斑機能)の保護と新生血管の発生防止を目的とする.
汎網膜光凝固による瘢痕面積は約20%とされる.これにより,増殖網膜症による重度視力障害は6年の経過観察で60%,黄斑症による中等度視力障害は3年の経過観察で66%,それぞれ抑制できる.
【 ☞ 光凝固のスタンス は 】
硝子体出血・網膜剝離などをきたした増殖網膜症に対し,出血混濁の除去・増殖膜の除去・牽引を解除・剝離した網膜を復位させる,などの観血的手段が必要となる.血管新生緑内障の発症も高率に抑制できる.硝子体細胞はマクロファージ由来と考えられ,サイトカインの存在によって血管内皮細胞の増殖に加担する.すなわち無硝子体であることは新生血管を発生しにくくする条件となる.
透過性亢進と新生血管発生に関わる主役はVEGFである.VEGFを制御できれば,ずいぶん予後が変わる訳である.
●抗VEGF薬: 抗VEGF(vascular endothelial growth factor)療法の目的は,網膜症における血管透過性亢進および内皮細胞増殖・管腔形成の抑制である.VEGFと結合する抗体により,VEGFとVEGF受容体との結合を阻害し,血管内皮細胞へのVEGFのシグナル伝達を遮断するメカニズムに基づく.眼内におけるVEGF産生を直接抑制している訳ではない.活動性の高い線維血管性増殖膜における新生血管や,虹彩および隅角新生血管の退縮のために効果的であるが,血管透過性の抑制はTAのほうが優位のようである. 硝子体内投与.
●副腎皮質ステロイド薬:
TA(triamcinolone acetonide)はVEGF受容体の発現阻害・シグナル伝達の調節ばかりでなく,密着結合タンパクの増加・リン酸化の減少,接着分子の発現抑制,白血球異常・活性化の抑制,PEDF(pigment epitheliumⲻderived factor)発現亢進,単球・ )最終的には,
視覚障害への対応 が求められる.
網膜は長期の血糖コントロールを記憶(metabolic memory)している,といわれる.
罹病期間×高血糖(HbA1C高値)=リスク因子,を意味している.
その他に,血糖値の変動(重症の低血糖),高血圧,妊娠,喫煙,肥満,年齢,腎症の存在,貧血(低酸素,等.
▩☞ Ⅰ型糖尿病では,罹病期間5年未満で17%,15⁓19年で81%に網膜症が認められた.
Ⅱ型糖尿病では,罹病期間5年未満で14%,15⁓19年で57%に網膜症が認められた.― 平成3年度糖尿病調査研究報告―より
▩☞ 9年の経過観察期間中,HbA1Cが平均 6%未満(JDS値)であれば網膜症発症は零であった. 8%以上では40%の有症率であった.初診時のHbA1Cが9%以上(JDS値)であるとき,その後の3年間のコントロールが平均7%であると5%,8%であると10%,9%では20%の網膜症発症であった.― 平成6年度糖尿病調査研究報告―より
▩☞ 空腹時血糖値で 126mg/dℓ 以上から,経口ブドウ糖負荷試験2時間値で 198mg/dℓ 以上から網膜症の頻度が増加した.
▩☞ 重度の低血糖は網膜症発症のリスクとなる.
▩☞ 30歳以下では,‘罹病期間’‘HbA1C高値’‘蛋白尿’‘拡張期血圧’,と‘重症度’が関連した.
▩☞ 30歳以上では,‘罹病期間(あるいは若年発症)’‘HbA1C高値’‘蛋白尿’‘収縮期血圧’‘BMI低値’,と‘重症度’が関連した.
▩☞ 高血圧は血管内皮の伸展・損傷をもたらしVEGFの活性化を促すと考えられることで,網膜症発症・進行の危険因子となる.
▩☞ 血清脂質値と網膜症の発症・進行との関連は明らかではないが,LDL╱HDL比の高値が動脈硬化を介して網膜症発症・進行に関与する,と考えられている.脂質異常の管理(脂質異常症治療薬)が網膜症進行の抑制に作用することが確認されている.
▩☞ 睡眠呼吸障害
La choroïdopathie diabétique (Saracco Jb et al:J Fr Ophtalmol 5,1982)によると,
網膜血管と同じような変化(filling delay ~ ischemic zone,microaneurysms,vascular anomalies,etc)がある,とのことである.
▩☞ 脈絡膜系は網膜血管系より流量が多く,豊富な吻合を有していることで,網膜外層は血管病変に基づく変化は起こりにくいともいわれている.
・白内障⬅高浸透圧化に伴う含水量の増加⬅房水・硝子体の高濃度グルコースによりソルビトール(代謝産物)が蓄積.
・角膜障害(知覚低下⬅神経症.
点状表層角膜症・再発性びらん・遷延性など⬅上皮基底膜異常や細胞接着障害による上皮症として.
内皮細胞の変形・密度の低下など⬅上皮異常の影響や細胞接着障害による内皮症として.
ほかに涙液分泌低下の影響など.
・縮瞳傾向,散瞳不良(糖尿病瞳孔),屈折・調節の変動⬅散大筋障害,交感神経障害.毛様体調節障害.
・虹彩毛様体炎⬅急性の線維素性前房蓄膿型が多い.細(小)血管症・虹彩色素上皮の障害.
いわゆる炎症細胞浸潤や毛様充血のない(強い毛様充血との記載アリ:調査中)ことが特異的とされる.
・眼筋麻痺(第3,4,6神経)⬅血管障害による末梢神経障害.
・視神経症⬅血管閉塞(乳頭深部では虚血性視神経症として,乳頭表層では糖尿病乳頭症として.
・ドライアイ⬅涙液分泌低下,
など
参照 ⇔ エッセンシャル眼科学 第8版 312ページ:糖尿病網膜症
▩☞診断基準の変遷
本邦で糖尿病学会が初めて診断基準について言及したのは1970年・昭和45年のことである.その後は 1982年,1999年,2010年と改訂になっている.
▩☞有病率
基準の修正により患者数を単純には比較できない.半世紀間の増加は統計のカラクリと研究者は言う.しかし,年齢が上がるにつれ有病率が高くなることで高齢者人口が増加することと合わせると,少なくとも減少することはない.
▩☞種類
1.I型糖尿病:自己免疫による膵β細胞の破壊
2.II型糖尿病:インスリン感受性の低下(インスリン抵抗性) と インスリン分泌低下
3.その他の特定の機序:遺伝子異常が同定されたもの と 他の疾患や病態に伴うもの とに大別
4.妊娠糖尿病
▩☞血糖
そもそも血糖とは,血液中に存在するブドウ糖(グルコース)を指している.各器官のエネルギー源となるグルコースは,食物中の炭水化物を消化した最終形態で,その量(濃度)が血糖値となる.食事の影響が必至のため,検査のタイミングが重要である.
空腹時血糖正常値…99mg∕dℓ以下
▩☞診断
*境界型:空腹時血糖値100⁓109mg∕dℓ を正常高値とし,要注意と見做す.空腹時血糖値100mg∕dℓ を超えると本物への移行率が高い,とのこと.
*診断基準:
①早朝空腹時血糖値 126mg∕dℓ 以上,
②75g経口糖負荷試験で 2時間値 200mg∕dℓ 以上,
③随時血糖値 200mg∕dℓ 以上,
④HbA1c値が 6.1%(JDS値;日本での測定法.欧米ではNGSP相当値=JDS+0.4)以上,
・初回検査で①②③④のいずれかを認めた場合「糖尿病型」と診断し,後日の再検査で①②③のいずれかで「糖尿病型」が確認されれば確定.または①②③のいずれかと④で「糖尿病型」が確認されれば確定.
・①②③のいずれかで「糖尿病型」を示し,かつ,ⓐ糖尿病の典型的症状(口渇,多飲,多尿,体重減少)の存在かⓑ確実な糖尿病網膜症の存在のいずれかで確定.
・ そのた
*内科管理
| 日本糖尿病学会「血糖コントロールの指標と評価」(2007) | |||||
|---|---|---|---|---|---|
| 指標 | 優 | 良 | 可 | 不可 | |
| 不十分 | 不良 | ||||
| HbA1c値(%) | 5.8 未満 | 5.8⁓6.5 未満 | 6.5⁓7.0 未満 | 7.0⁓8.0 未満 | 8.0 以上 |
| 空腹時血糖値(mg/dℓ) | 80⁓110未満 | 110⁓130未満 | 130⁓160未満 | 160以上 | |
| 食後2時間血糖値(mg/dℓ) | 80⁓140未満 | 140⁓180未満 | 180⁓220未満 | 220以上 | |
| 日本糖尿病学会「血糖コントロールの目標」(2013・熊本宣言) | |||||
|---|---|---|---|---|---|
| コントロール目標値(※4 | |||||
| 目標(NGSP値) | 血糖正常化を目指す際の目標(※1 | 合併症予防のための目標(※2 | 治療強化が困難な際の目標(※3 | ||
| HbA1c値(%) | 6.0未満 | 7.0未満 | 8.0未満 | ||
※1 適切な食餌療法や運動療法だけで達成可能な場合,または薬物療法中でも低血糖などの副作用なく達成可能な場合の目標とする.
※2 合併症予防の観点からHbA1cの目標値を7%未満とする.対応する血糖値としては,空腹時血糖値 130mg/dℓ未満,食後2時間血糖値 180mg/dℓ未満をおおよその目安とする.
※3 低血糖などの副作用,その他の理由で治療の強化が難しい場合の目標とする.
※4 いずれも成人に対しての目標値であり,また妊娠例は除くものとする.
▩☞ HbA1c:糖化ヘモグロビンと国際標準化.
グルコースと結合したヘモグロビン.血糖マーカーとして過去2か月前後の平均的な血糖の状態を反映する.統計学的に糖尿病の血管合併症の発症予測,予防のための指標になっている.HbA1Cの基準範囲は4.3〜5.8%(JDS値).例えば,10%超だと入院管理をすすめられたりする.
グルコースがヘモグロビンに結合する部位がいくつかあり,研究分野・測定試薬で測定値がチッとずつ違っていた.日本での測定法(JDS値)は歴史があり高精度とのことであるが悲しいかな試薬がマイナーらしく,標準化が遅れたにもかかわらず世界的には(論文として発表されている検査法として)NGSP値が多数を占めていることでアメリカに押し切られ,国際化のために多勢に傾くことになり2011年中に欧米での表記に右倣えするそうである.NGSP相当値=JDS(%)+0.4 ということで,切り替えの日付に注意!)
*JDS:japan diabetes society [https://www.jds.or.jp/
*NGSP:national glycohemoglobin standardization program
臨床の場での切り替えは2012年4月1日 とのことである.NGSP相当値というからには元データはJDS値になるのかな.
▤ 『HbA1c国際標準化』
そんなわけで2012年平成24年度から本格的にNGSP値が導入されることになった.要するに但し書きを付ける必要がある,ということだ.但し書きには三種類ある.「JDS値」「国際標準値」「NGSP値」である.現在まで(おそらく将来的にも)日本での測定用試薬(認証標準物質)による数値が「JSD値」ということで,国際標準値(%)=JDS値(%)+0.4(%)になる.2011年時には「NGSP相当値」と言ってたもので概算値らしい.その後,検証が済んだとのことで換算式が確定した.すなわち,NGSP値(%)=1.02×JDS値(%)+0.25 または JDS値(%)=0.980×NGSP値(%)-0.245,ということでJDS値(%)の 5.0⁓9.9 のレンジでは NGSP値(%)=JDS値(%)+0.4 が成り立つことにより国際標準値をNGSP値とすることに矛盾しない,との見解である.
2014年4月以降 NGSP値へ完全移行されるとのことである.
▩☞ GA:グリコアルブミン(糖化アルブミン.
グルコースと結合したアルブミンで,過去2週間前後の平均的な血糖の状態が把握できる.基準値は12.3⁓16.3%で,高血糖状態では高値になる.
HbA1c値は指標として認知されているが,HbA1c値は透析患者にとって見かけ上低くなることで,GA値を推奨する研究者も多い.この場合,3で割ってHbA1cの換算値とする.
▩☞ 1,5 AG:1,5 アンヒドロ-D-グルシトール.
数日ぶんの日内変動による瞬間的な高血糖は,“1,5 AG”値に反映される.食後血糖値の変動も把握できるとのことである.
基準値は14μg/mℓ 以上(男性15〜45╱女性12〜29)で,高血糖状態では低値になる.
▩☞1型と2型
*1型:インスリン依存型糖尿病
膵β細胞の破壊によりインスリンが出ない.全体の1割ほどで,主に若年者となる.自己免疫疾患とされているが,炎症が証明されない特発性も多い.
*2型:インスリン非依存型糖尿病
でぶ体型のインスリン抵抗性(インスリン感受性の低下)とやせ体型のインスリン分泌不全がある.これに遺伝因子と環境因子(生活習慣 ―肥満・喫煙・運動不足)が関わる.全体の9割ほどで,主に中高年となるが近年,10代発症の2型DMが重要視されている,とか.ヤングはやはり,疾患への認識がなく網膜症を重症化させてしまうとのことである.
*インスリン分泌には基礎分泌と追加分泌があり,病初期には追加分泌の立ち上がりが鈍いために食後高血糖を示し,進行すると基礎分泌の低下のため空腹時高血糖を示すようになる.
インスリン分泌能の進行性の低下は膵β細胞の機能低下であり,ここに小胞体ストレスによるβ細胞死(アポトーシス)が想定されている.
▩☞ その他のコントロール指標
標準体重の維持:BMI≒22kg/m2
血圧:140/80mmHg未満
総コレステロール:200mg/dℓ未満
中性脂肪(早朝空腹時:150mg/dℓ未満
LDL‐コレステロール:120mg/dℓ未満
HDL‐コレステロール:40mg/dℓ以上
▩☞ 妊娠中の糖代謝異常については,『耐糖能異常を伴う妊娠』という表現で括られる.
疾患発症背景から三型に分けている.
㈠ 糖尿病合併妊娠(pregestational diabetes):妊娠前から糖尿病が存在する
㈡ 妊娠中に発見される糖代謝異常
⒈ 妊娠糖尿病(gestational diabetes):
妊娠中にはじめて発見または発症した糖代謝異常を指し,明らかな糖尿病は含めない.妊娠女性の高齢化により増加(35歳以上の妊婦では25歳未満より8倍).
⒉ 妊娠時に診断された明らかな糖尿病:
それまで見逃されていたと考えられる耐糖能異常
▩☞ 合併症
⒈ 母体では,妊娠高血圧症候群,流産,早産,羊水過多,など
⒉ 児では,胎児死亡,先天異常,巨大児(胎児の過体重),新生児低血糖,など
* 妊娠中は機序はよくわかっていないものの,HbA1cが低下することが知られており,妊娠後期では約0.5%HbA1cが低下する.
糖尿病の合併症は,通常は神経障害と網膜症の後に腎症が発症する.これにより,糖尿病性腎症の診断に糖尿病網膜症の存在は参考になる (diabetic kidney disease;DKD). 【 📖 DKD 】
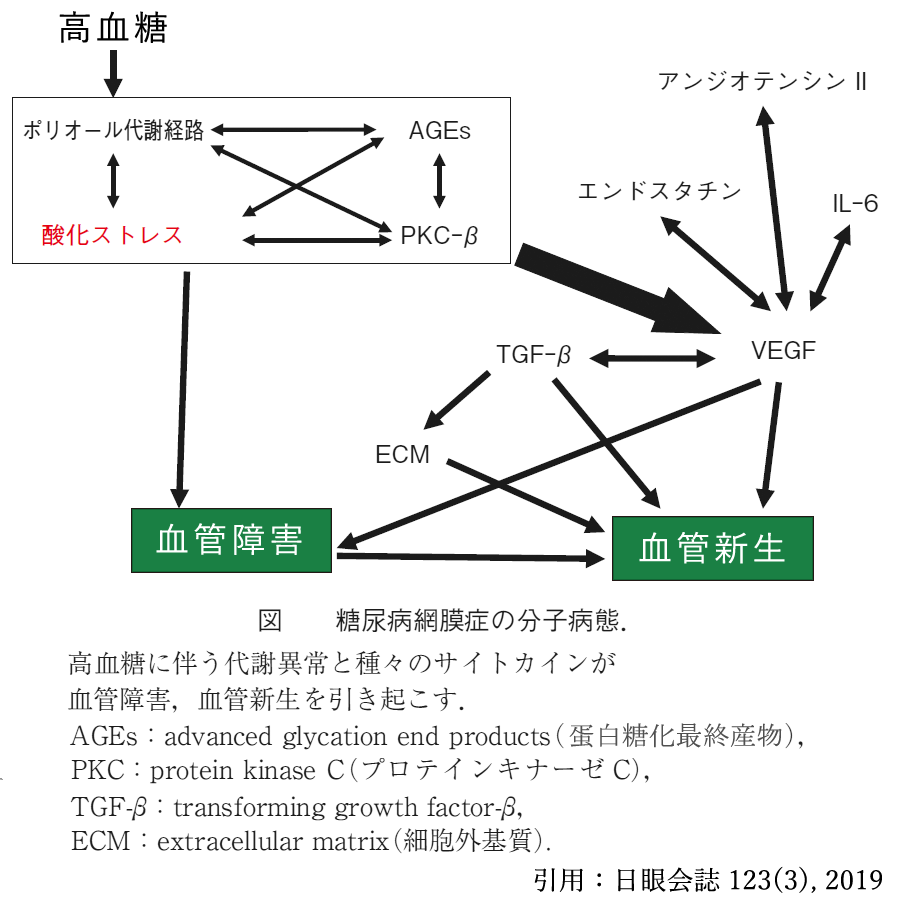
網膜症発症・進行の主なメカニズムとして ❶ポリオール代謝経路の亢進,❷酸化ストレス,❸蛋白糖化最終産物AGEsの蓄積,❹プロテインキナーゼCの活性化,が4つの大きなものと考えられている.これらの相互反応により,血管内皮増殖因子 vascular endothelial growth factor ❶ ポリオール経路:
ポリオール経路は,グルコースがアルドース還元酵素 (Aldose reductase
❷
酸化ストレス: ❸ 糖化(グリケーション):
*AGEの代謝排泄経路は主に腎臓である.
糖尿病では高血糖によりAGEs産生が亢進し,糸球体基底膜,メサンギウム細胞,足細胞,尿細管細胞,血管内皮細胞など,様々な細胞や部位へAGEsが過剰に沈着し,細胞障害が促進される.
メサンギウム細胞による細胞外基質産生を亢進させることも指摘されている.
【 📖
DKD 】
*慢性腎臓病∕透析状態では非糖尿病に於いても,AGEの過剰蓄積が心血管病発症に関与していることが示唆されている.
❹ プロテインキナーゼC (protein kinase C;PKC) 活性化: 高血糖状態では網膜,腎臓,心臓,大動脈などの組織においてPKC᠆βアイソフォームの活性が亢進する. 【出典・参考:https://www.igakuken.or.jp/medical/medical03/03-1.html】
2025 【プリントアウトは縮小80%を推奨】
通常では,細胞内に取り込まれたブドウ糖(グルコース:
*増殖因子
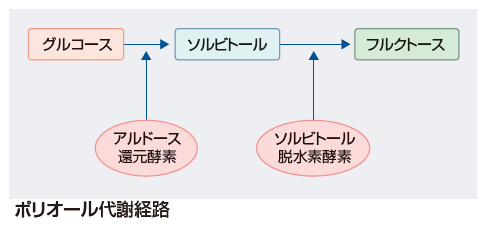
ソルビトールは細胞内の浸透圧を上昇させると共に,細胞内情報伝達に重要なミオイノシトール,タウリンなどの取り込みを阻害する.またAR活性が上昇することで,補酵素である還元型ニコチンアミドアデニンジヌクレオチド燐酸(NADPH)が大量に消費される.一酸化窒素(NO)合成酵素や還元型グルタチオン産生酵素もNADPHを補酵素として利用するため,NADPHの減少でNOや還元型グルタチオンの合成が低下する.NOの低下は血流の異常や虚血(低酸素環境),血管内皮細胞障害を,還元型グルタチオンの減少は酸化ストレスの亢進を招くと考えられている.
フルクトースは次のような酸化ストレスや糖化(グリケーション)に関与し,網膜血管壁構成細胞を傷害する.
*低酸素環境ではVEGF誘導のほか血栓形成が促進する.
*NO:血管拡張因子
細胞内に取り込まれた酸素(O₂)の代謝過程で生じる,反応性の高い分子が活性酸素である.過剰となった活性酸素は,DNA,タンパク質,膜脂質などに傷害を与える.
高血糖下では,ブドウ糖の自己酸化,ポリオール代謝亢進による還元型グルタチオンの減少,糖化による抗酸化酵素の活性低下,PKC活性異常などが密接に関連し,酸化ストレスを亢進させる.AGE形成が促進する.
*抗酸化成分の摂取が網膜症を抑制する.
過剰の糖が酵素の触媒を介さず(非酵素的糖化)にタンパク質と結合する現象である.
典型的な糖化タンパクがグリコヘモグロビンで,他の血漿タンパクや細胞成分,細胞間質等も糖化される.糖化タンパクは細胞の構造や機能を障害すると共に,フリーラジカル分子を発生させる.さらに糖化タンパク同士で架橋を形成し,不溶性の大分子である蛋白糖化最終産物 advanced glycation end products(AGEs)を作る.
AGEsは血管内皮細胞やマクロファージ等の表面にあるAGE受容体(receptor for AGE;RAGE)に結合し,サイトカインや活性酸素の産生を刺激する.
内皮細胞は tight junctionの開離,窓構造の形成,細胞膜傷害,増殖の促進などをきたす.
周皮細胞 pericyte は変性・消失する.
基底膜では,細胞外マトリクスの生産過剰や血漿タンパクの沈着で,肥厚(細小血管硬化)する.
損傷した内皮細胞からは VEGF が誘導され,或いはプロスタサイクリン産生を低下させて血栓傾向を引き起こし,血管新生と血栓形成をきたしうることになる.
これらは網膜症の発症・進展の起点として 血液網膜関門の破綻 を意味し,特徴的な細小血管症の基である.増殖網膜症および黄斑浮腫患者における硝子体中のVEGF濃度は,非糖尿病患者に比較して有意に高い.活動性の高い新生血管や線維血管性増殖膜を有する例においては高値を示す.また,黄斑部網膜厚(浮腫)や血管透過性亢進の程度と相関する.
並行して,マクロファージの網膜遊走をもたらし,血管平滑筋が増殖する.
プロテインキナーゼはATPのリン酸基をタンパク質の水酸基に転位させるリン酸化酵素の総称である.
構造や生化学的性質の違いに基づき多くの型(アイソフォーム)に分類され,環状AMPによって活性化されるプロテインキナーゼA,カルシウムによってイノシトール脂質の代謝回転を介して活性化されるプロテインキナーゼC,カルモジュリン依存性プロテインキナーゼなどがある.
細胞内の第2次メッセンジャーとして種々の細胞内情報伝達・細胞機能の調節に重要な役割を担う.
☞☞ リン酸化
活性化PKC᠆βはさまざまなシグナル伝達系を介して血流調節異常や血管新生の誘導を引き起こし,網膜症や腎症の進行に関与すると考えられている.神経組織ではPKC᠆αアイソフォームの活性低下とともに神経内細小血管におけるPKC᠆βの活性亢進が報告されている.